Bacterie bouwt nieuw transportsysteem
Biologen kennen twee manieren waarop cellen stoffen opnemen of uitscheiden door hun celmembraan: passief transport door selectieve poriën, aangedreven door een verschil in concentratie en actief transport via eiwitcomplexen die daarvoor chemische energie gebruiken. Maar nu hebben onderzoekers van de RUG, samen met collega’s uit Duitsland en Spanje, een systeem ontdekt dat bestaat uit de combinatie van een porie en een transporteiwit. Hiermee kunnen cellen kalium importeren zelfs als de concentratie buiten de cel extreem laag is. De ontdekking is op 26 november gepubliceerd in het tijdschrift Nature Communications.
Cristina Paulino, hoofd van de cryo-elektronenmicroscopie groep van de afdeling Structurele Biologie, is enthousiast: ‘Dit kan zomaar in de leerboeken terechtkomen.’ Het nieuwe transportsysteem combineert twee werelden die altijd los van elkaar werden gezien. Passieve poriën en actieve transporteiwitten hebben een verschillend werkingsmechanisme, een verschillende evolutionaire geschiedenis en worden bestudeerd door verschillende groepen onderzoekers, elk met een eigen taal en eigen conferenties. Twee werelden die elkaar lijken uit te sluiten. ‘Maar wij laten zien dat het niet zo zwart-wit is.’

Extreem
Samen met haar collega Inga Hänelt van de Goethe Universiteit Frankfurt (Duitsland) heeft Paulino een chimaera ontdekt van een porie en een transporteiwit die voorkomt in de darmbacterie E. coli en enkele verwante soorten. Deze bacteriën hebben onderdelen van beide systemen aan elkaar geknutseld zodat er iets nieuws is ontstaan. ‘Het is fascinerend om te zien dat de natuur dit voor elkaar heeft gekregen’, zegt Paulino.
Cellen gebruiken het nieuwe transportsysteem, met de naam KdpFABC, om kalium ionen de cel in te krijgen. Het systeem is pas actief onder extreme condities, wanneer de kaliumconcentratie buiten de cel zo’n tienduizend keer lager is dan in de cel. Paulino: ‘Wanneer de concentratie buiten de cel zo laag is, heb je zeer hoge affiniteit nodig om kalium ionen te binden. Vervolgens moet het systeem een zeer hoge energiebarrière overwinnen om het kalium te importeren.’
Onderdelen
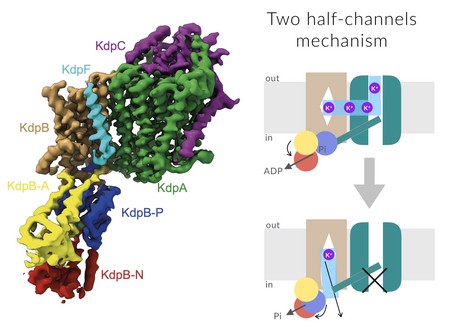
Poriën zijn doorgaans zeer selectief en hebben een hoge affiniteit, maar alleen actief transport kan de energiebarrière overwinnen. Dus hoe kan KdpFABC beide doen? De onderzoekers begrepen dat het antwoord moest liggen in de structuur van het eiwitcomplex, dat bestaat uit vier onderdelen. Vorig jaar is er al een structuur van dit complex beschreven, verkregen via röntgendiffractie. Die structuur bevestigde dat één onderdeel van het complex eruit zag als het kanaal van een porie, en een ander als een eiwit voor actief transport. ‘Maar naar ons idee was er iets mis met het transportmechanisme dat deze onderzoekers voorstelden op basis van de structuur. Het overtuigde niet, er ontbrak iets.’

Paulino en haar promovenda Lisa Hielkema, die gedeeld eerste auteur is van het artikel, besloten daarom de structuur nog eens goed te bestuderen. Daarvoor gebruikten zij cryo-elektronenmicroscopie, een techniek waarbij met een speciale elektronenmicroscoop details van een paar Ångström kunnen worden gezien. De microscoop maakt beelden van duizenden exemplaren van het eiwitcomplex, die dan worden gecombineerd. ‘We gebruikten remmers om er voor te zorgen dat de complexen allemaal in dezelfde toestand waren gestabiliseerd, want tijdens het transportproces veranderen ze van vorm.’ Maar ondanks de remmers bleken er toch twee verschillende vormen van het complex aanwezig te zijn. Dat was gunstig, want de twee vormen tonen twee stadia in het transportproces.
Tunnels
Zowel het kanaal als het actief transporteiwit waren duidelijk zichtbaar in de analyse van de structuur die Paulino en Hielkema maakten. Maar de structuur van het kanaal veranderde niet tijdens transport en het opende zich niet aan de binnenkant van de cel. Paulino en haar collega’s zagen wel tunnels, waardoor de kalium ionen van buiten het kanaal in konden, om van daar naar het transporteiwit te gaan en door een tweede tunnel naar het binnenste van de cel.
Het transportmechanisme dat deze structuur suggereert is uniek, legt Paulino uit. ‘De porie bindt de kalium ionen aan de buitenkant met hoge affiniteit. Die ionen stromen het transportcomplex in, wat weer zorgt voor een verandering in de vorm die energie kost.’ De transporteenheid verbruikt hierbij ATP, de universele energiedrager van de cel, als brandstof om een tunnel te openen naar de binnenkant van de celmembraan. De verandering in de vorm vermindert ook de affiniteit voor kalium, zodat de ionen daar los komen van het transportcomplex.
Dogma
‘Het systeem gebruikt een porie die is geëvolueerd met een hoge aantrekkingskracht voor kalium ionen samen met een pomp die evolueerde om transport uit te voeren tegen een hoge energiebarrière in’, zegt Paulino. Dit systeem doet de grens tussen poriën en actieve transporteiwitten vervagen. ‘Deze ontdekking doorbreekt het dogma dat die twee systemen elkaar uitsluiten. Wij beschrijven een totaal nieuwe mechanisme dat oude concepten op een unieke manier combineert.’
Referentie: C. Stock, L. Hielkema, I. Tascón, D. Wunnicke, G. T. Oostergetel, M. Azkargorta, C. Paulino & I. Hänelt: Cryo-EM structures of KdpFABC suggest a K+transport mechanism via two inter-subunit half-channels. Nature Communications, 26 November 2018
| Laatst gewijzigd: | 28 november 2018 17:00 |
Meer nieuws
-
10 juni 2024
Om een wolkenkrabber heen zwermen
In Makers van de RUG belichten we elke twee weken een onderzoeker die iets concreets heeft ontwikkeld: van zelfgemaakte meetapparatuur voor wetenschappelijk onderzoek tot kleine of grote producten die ons dagelijks leven kunnen veranderen. Zo...
-
21 mei 2024
Uitslag universitaire verkiezingen 2024
De stemmen zijn geteld en de uitslag van de universitaire verkiezingen is binnen!

