Extreme microscopie toont eilandjes in celmembraan gist
Microbiologen van de RUG hebben kleine eilandjes in beeld gebracht in de celmembraan van bakkersgist. Het lijkt erop dat deze compartimenten in de membraan transporteiwitten opslaan totdat ze nodig zijn. De onderzoekers zagen dat de eiwitten zich zeer traag verplaatsen in de celmembraan en ontdekten hoe ze de eilandjes bereiken. De observaties zijn gedaan met de modernste extreem hoge resolutie microscopen en zijn op 5 februari gepubliceerd in het tijdschrift Nature Communications.
Tot een jaar of tien geleden zag je de plaatjes nog in alle leerboeken: de celmembraan als een homogene dubbellaag van lipiden (vetzuren) waar zo hier en daar eiwitten in zaten. Maar dat beeld is inmiddels drastisch bijgesteld, door de ontdekking dat de membraan van zoogdiercellen uit verschillende fasen bestaat. De samenstelling van de lipiden verschilt tussen ‘eilandjes’ en de rest van membraan, wat weer invloed heeft op de verdeling van eiwitten. Maar of dit ook gold voor gistcellen was nog onzeker.

‘Studies met elektronenmicroscopie uit de jaren 1960 laten een soort kuiltjes zien in de gistmembraan. Maar die zijn nooit verder bekeken, ze werden afgedaan als artefacten, ontstaan door de gebruikte technieken’, legt RUG hoogleraar biochemie Bert Poolman uit. ‘Maar ongeveer tien jaar geleden zijn die kuiltjes opnieuw ontdekt. Wetenschappers zagen daarin banaanvormige eiwitten aan de binnenkant van de membraan en die bleken verantwoordelijk te zijn voor het ontstaan van de kuiltjes.’ De kuiltjes waren dus echt en heten nu eisosomen.
Poolman had verschillende redenen om deze kuiltjes in gistcellen te bestuderen. ‘We zijn nauw betrokken bij een project om een synthetische cel op te bouwen uit moleculaire onderdelen. Dus moeten we veel weten over de membraan en willen we membraaneiwitten in handen kunnen krijgen.’ Daarnaast blijken in de eisosomen bepaalde transporteiwitten te zitten waarin industriële partners van de groep van Poolman geïnteresseerd zijn.
Transporteurs
Voor het onderzoek zijn verschillende fluorescerende moleculen gebruikt die specifiek binden aan de transporteiwitten of de banaanvormige eiwitten aan de binnenkant van de eisosomen. Zo konden de onderzoekers in de groep van Poolman bepalen welke transporteiwitten vooral in die eisosomen zaten. Aangezien deze kuiltjes maar zo’n 50 nanometer diep zijn en een doorsnede hebben van maximaal zo’n 100 tot 150 nanometer, was er een behoorlijk hoog oplossend vermogen nodig om dit te zien. ‘Gelukkig is ons lab uitgerust met enkele microscope die zo’n extreem oplossend vermogen hebben en daarnaast gevoelig genoeg zijn om individuele moleculen in levende cellen te observeren.’ De combinatie van ervaring met extreem hoge resolutie microscopie en met de biochemie van celmembranen zorgde ervoor dat deze onderzoeksgroep dit kunststukje kon volbrengen.
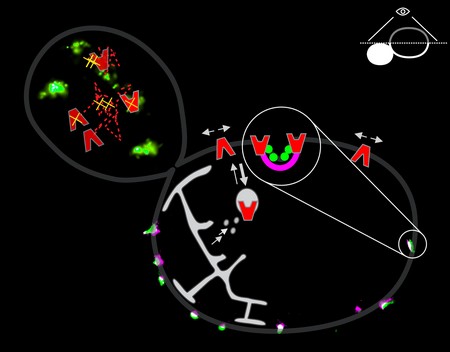
Het onderzoek liet zien dat sommige transporteurs van aminozuren inderdaad bij voorkeur in de eisosomen zitten. ‘Maar alleen wanneer de aminozuren die ze transporteren niet aanwezig zijn’, legt Poolman uit. ‘Wanneer we die toevoegen, verlaten de eiwitten de eisosomen. Vermoedelijk verandert door binding van hun substraat de vorm van het eiwit.’ Poolman vermoedt dat de eisosomen de transporteiwitten beschermen tegen recycling. ‘De eiwitten worden binnenin de cel gemaakt en dan naar de membraan gebracht via een proces dat exocytose heet. Maar als ze niet in een eisosoom terechtkomen worden ze al snel weer naar binnen gehaald via endcytose.’ Daarom is het nodig de transporteiwitten op te slaan in de eisosomen. Pas als het juiste substraat aanwezig is komen ze eruit om aminozuren op te nemen totdat dit niet langer nodig is en ze alsnog worden gerecycled.
Diffusie
Niet alle membraaneiwitten zitten in de eisosomen. Poolman: ‘We zagen bijvoorbeeld dat eiwitten waarvan een groot stuk zich binnenin de cel bevindt niet in deze domeinen terechtkomen.’ Vermoedelijk zitten het intracellulaire deel van de eiwitten en de banaanvormige eiwitten van het eisosoom elkaar in de weg.
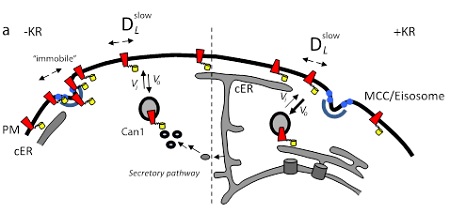
Het onderzoek van de groep van Poolman laat ook zien hoe snel eiwitten in de plasmamembraan van gist kunnen diffunderen. Dat bleek ongeveer duizend keer trager te zijn dan in zoogdiercellen, of in de membranen binnenin de gistcel. ‘De plasmamembraan van gist is nogal stijf. Mede daardoor kan die hoge concentraties alcohol of zuur weerstaan. Maar het heeft dus blijkbaar ook gevolgen voor de diffusiesnelheid van eiwitten.’
De onderzoeksresultaten geven een beter beeld van de manier waarop de membraan van gistcellen functioneert, vooral in de eisosoom-eilandjes. En dit biedt nieuwe inzichten in productie en transport van membraaneiwitten, wat nuttig is bij het verbeteren van gist als industrieel productieplatform voor eiwitten.
Referentie: Frans Bianchi, Lukasz Syga, Gemma Moiset, Dian Spakman, Paul E. Schavemaker, Christiaan M. Punter, Anne-Bart Seinen, Antoine M. van Oijen, Andrew Robinson and Bert Poolman: Steric exclusion and protein conformation determine the localization of plasma membrane transporters. Nature Communications 5 February 2018.
| Laatst gewijzigd: | 07 februari 2018 12:59 |
Meer nieuws
-
30 januari 2025
Uitgelichte publicaties december 2024 - januari 2025
Lees hier over de uitgelichte publicaties van december/januari: nieuwe inzichten in elektronica van 2D materialen en in de eiwitklonten die de ziekte van Huntington veroorzaken.
-
28 januari 2025
Het heelal bestuderen om de wereld te begrijpen
Door de kosmos te begrijpen, kunnen we ook de fundamenten van onze wereld beter doorgronden. Dat is de gedachte achter het onderzoeksthema Fundamentals of the Universe, waarin drie instituten van de Rijksuniversiteit Groningen op unieke manier...
-
27 januari 2025
Werken aan betere AI (met minder geld dan de VS)
De VS gaat een duizelingwekkend bedrag van 500 miljard euro investeren in AI. Aan de Rijksuniversiteit Groningen werken onderzoekers juist aan Future-Proof Computing: energiezuinigere hardware en verantwoorde AI die kan samenwerken met de mens.

