Werking van moleculaire pomp in beeld gebracht
Onze cellen maken gebruik van allerlei eiwitten die nuttige stoffen naar binnen transporteren. De motor van deze pompen draait op een stroom deeltjes, vaak natrium-ionen, een beetje zoals water een waterrad aandrijft. Maar hoe dat precies gebeurt was een raadsel, dat nu door Groningse biologen is opgelost. Het antwoord is op 10 november gepubliceerd in het tijdschrift Nature Communications.
Het staat in aller leerboeken biologie: transport van buiten naar binnen (of omgekeerd) in cellen draait op een concentratieverschil in deeltjes binnen en buiten. Buiten de cel is de concentratie natrium-ionen doorgaans veel hoger dan binnen, voor kalium geldt het omgekeerde. Maar hoe werkt die aandrijving precies? Dat weten we eigenlijk niet, vertelt RUG-hoogleraar biochemie Dirk Slotboom.

‘We weten wel dat bijvoorbeeld drie natrium-ionen nodig zijn om een molecuul aspartaat, een belangrijke grondstof voor eiwitten, een cel in te krijgen. Alleen hoe het transporteiwit dat precies voor elkaar krijgt heeft nog niemand kunnen ontdekken.’ Duidelijk is wel dat op de een of andere manier natrium en aspartaat samen getransporteerd moeten worden. ‘Als natrium ook alleen de cel in kan, zou het concentratieverschil verdwijnen. En als aspartaat zonder natrium is te transporteren, zou het ook weer naar buiten kunnen gaan.’
Kristal
Om het transportmechanisme te achterhalen was het nodig de 3D structuur van het transporteiwit, met en zonder natrium en aspartaat, nauwkeurig te kunnen bepalen. Zo’n structuur wordt bepaald met röntgendiffractie, en voor die techniek is het nodig om kristallen van het eiwit te laten groeien. De kwaliteit van het kristal bepaalt hoe gedetailleerd de structuur zichtbaar is. ‘Er was wel een structuur, maar die had een tamelijk lage resolutie, en je kon er de natrium niet in zien zitten.’
Van het transporteiwit bestaan tal van varianten in verschillende soorten cellen. Slotboom en zijn collega’s gingen op zoek naar een variant die betere kristallen zou opleveren. Dat is een langdurig proces, maar het leverde uiteindelijk een goed resultaat op: structuren van het eiwit met en zonder natrium en aspartaat. ‘We hadden dus twee punten in het proces, het lege en het volle transporteiwit. Met behulp van simulaties hebben we berekend wat de stappen daartussen zijn geweest.’
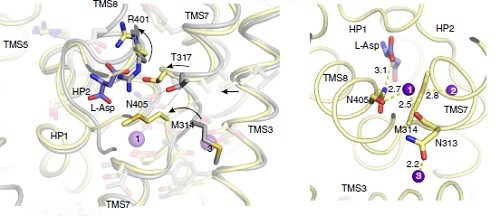
Dit levert een mechanisme op dat de werking verklaart. De lege vorm van het eiwit heeft helemaal niet de neiging om aspartaat te binden, en een zwakke neiging tot het binden van natrium. Maar als er dan één natrium-ion aan vast gaat zitten, verandert de structuur en volgt een tweede natrium. Opnieuw verandert de structuur en ontstaat een plek waar aspartaat zich heel erg thuis voelt. ‘En na de binding van aspartaat ontstaat een bindingsplek voor een derde natrium-ion’, legt Slotboom enthousiast uit.
Dekseltje
Als dat derde ion vastzit aan het transporteiwit, vindt de laatste structuurverandering plaats. ‘Er gaat als het ware een dekseltje dicht, waarna het eiwit de deur naar buiten dicht doet, en er een deur naar binnen open gaat.’ Het derde natrium-ion is zeer zwak gebonden, dus het laat ook gemakkelijk los. Dit zorgt ervoor dat ook het aspartaat loslaat, en de overige twee natrium-ionen. De binnendeur slaat dicht, de buitendeur gaat open en het proces kan opnieuw beginnen.
Het is een elegant systeem, vindt Slotboom: ‘Alle stappen zijn nodig voor transport, aspartaat kan pas binden als er twee natrium-ionen aan het eiwit zitten, maar voor transport is het derde ion nodig dat de deur dicht doet. En de zwakke binding van dat derde ion zorgt voor het loslaten van de lading.’ Dit soort transporteiwitten komt voor in allerlei cellen en is uiterst belangrijk. Nauwkeurige kennis van het werkingsmechanisme kan dus helpen om bijvoorbeeld een cruciaal transport in schadelijke bacteriën plat te leggen. Maar die volgende stap zal weer heel veel nieuwe onderzoek vragen.
Referentie: Albert Guskov, Sonja Jensen, Ignacio Faustino, Siewert J. Marrink & Dirk Jan Slotboom: Coupled binding mechanism of three sodium ions and aspartate in the glutamate transporter homologue GltTk. Nature Communications, 10 November 2016, doi 10.1038/ncomms13420
| Laatst gewijzigd: | 11 november 2016 15:38 |
Meer nieuws
-
20 december 2024
NWO M1-subsidie voor drie FSE-onderzoekers
Dr. Antonija Grubišić-Čabo, dr. Robbert Havekes en prof. dr. ir. Jan Komdeur ontvangen een NWO M1-subsidie.
-
19 december 2024
NWO ENW-XL-miljoenenbeurzen voor onderzoeksprojecten RUG
Vier onderzoekers van de Faculty of Science and Engineering (RUG) ontvangen NWO beurzen van 3 miljoen euro voor hun onderzoeksprojecten.
-
19 december 2024
Jacquelien Scherpen geëerd met Hendrik W. Bode Lecture Prize 2025
Vanwege haar verdiensten voor de wetenschappelijke ontwikkelingen van regelsystemen en -techniek heeft Rector Magnificus Jacquelien Scherpen de 2025 Hendrik W. Bode Lecture prijs ontvangen van de IEEE Control Systems Society (CSS).

