Nieuw licht op eiwit dat ziekte van Huntington kan bestrijden
Kort & bondig
De cellen in ons lichaam hebben een speciaal afvalverwerkingssysteem om beschadigde eiwitten te verwijderen. Bij de ziekte van Huntington ontstaan eiwitklonten die hersencellen beschadigen en uiteindelijk doden. Om ze op te ruimen is het belangrijk te weten hoe het afvalsysteem, dat zelf uit eiwitten bestaat, de klonten kan opruimen. Wetenschappers bestudeerden een afvalverwerkingssysteem dat de vorming van eiwitklonten, zoals bij de ziekte Huntington, kan voorkomen. Omdat de opruim-eiwitten zelf ‘goede’ klonten vormen, was de structuur ervan lastig te achterhalen. Met speciale technieken ontdekten de onderzoekers dat twee delen van het opruim-eiwit normaal gesproken aan elkaar plakken. Maar als ze eiwitklonters tegenkomen, laten ze elkaar los en kunnen ze zich binden aan een ander eiwit, dat goed is in het oplossen van de klonten. In de verre toekomst kan deze informatie helpen bij het ontwikkelen van een geneesmiddel dat vorming van schadelijke eiwitklonten voorkomt.
Bij de ziekte van Huntington ontstaan klonten van een verkeerd gemaakt eiwit in hersencellen, die daar uiteindelijk aan doodgaan. De zogeheten heat shock proteins (hitte-schok eiwit) kunnen het ontstaan van die klonten in principe voorkomen. Maar het is niet goed duidelijk hoe ze zich aan het Huntington-eiwit binden. Onderzoek van Patrick van der Wel (RUG) en collega’s van de universiteit van Texas heeft nieuw licht geworpen op de structuur van een heat shock protein dat bindt aan de klonterende eiwitten, en helpt te begrijpen hoe dit werkt. De resultaten zijn op 11 februari gepubliceerd in het tijdschrift Nature Communications.
Door René Fransen (ScienceLinX)
Cellen maken verschillende heat shock proteins (Hsp’s) tijdens stressvolle omstandigheden. Het is een eiwitfamilie met grote diversiteit en veel ervan werken als ‘chaperonnes’. Dit betekent dat ze andere eiwitten helpen om zich op de goede manier te vouwen, of opnieuw te vouwen na beschadiging. ‘Deze Hsp’s kunnen duizenden verschillende eiwitten helpen met vouwen. Daarvoor gebruiken ze co-chaperonnes met specifieke bindingseigenschappen’, legt adjunct hoogleraar vaste stof NMR spectroscopie aan de RUG Patrick van der Wel uit.

Orde
Een van de Hsp klassen, Hsp40, helpt bij het opruimen van eiwitklonters. De Hsp40 eiwitten bestaan ook weer in verschillende varianten en een aantal ervan bindt zich vooral aan klonterende eiwitten waarin het aminozuur glutamine herhaaldelijk voorkomt, zoals in het foutieve eiwit dat bij de ziekte van Huntington wordt gevonden. Een van die Hsp40 varianten, met de naam DnaJB8, is door Van der Wel en zijn collega’s bestudeerd.
‘Om te begrijpen hoe DnaJB8 werkt moet je weten hoe het eruit ziet’, zegt Van der Wel. Maar het is lastig de structuur van dit soort eiwitten te achterhalen. ‘Het eiwit komt voor in groepjes van twee of meer, waarbij een aantal eiwit-eenheden samenwerken. Maar hun structuur is niet erg geordend.’ En voor de standaard technieken om de eiwitstructuur te bepalen is die orde juist nodig.
Koolstofatomen
Van der Wel kreeg dit probleem voorgelegd via collega’s van de universiteit van Texas. Hij is gespecialiseerd in vaste stof NMR spectroscopie, een techniek waarmee hij kan meten hoe atomen aan elkaar vast zitten in een molecuul. Simpel gezegd, het NMR signaal dat twee koolstofatomen in DnaJB8 afgeven hangt af van hoe ze reageren op andere atomen in het eiwitmolecuul. Op die manier onthult het gemeten spectrum in welk aminozuur de koolstofatomen zich bevinden. Die informatie helpt om een idee te krijgen van de structuur van het hele eiwit, zelfs als het niet erg geordend is.
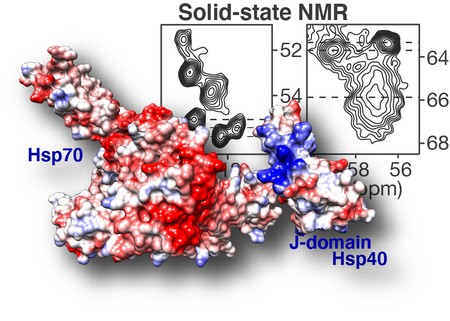
Het DnaJB8 eiwit bestaat uit verschillende domeinen met verschillende functies. Via een serie experimenten ontdekte Van der Wel welke domeinen aan de binnenkant van DnaJB8 zitten en welke aan de buitenkant, waar ze interacties met andere eiwitten kunnen aangaan. De structurele informatie liet zien dat het zogeheten J-domein van DnaJB8 kan schakelen tussen een geblokkeerde stand en een open stand. Dit is belangrijk, omdat dit deel van het eiwit verantwoordelijk is voor de activatie van Hsp70, dat de vorming van eiwitklonten kan voorkomen. Er is dus een ‘schakelaar’ in DnaJB8 die de interactie met Hsp70 controleert. Een interessante observatie is dat die schakelaar zit op een plek in het DnaJB8 domein waarvan de exacte functie nog onbekend was.
Hypothese
‘Onze hypothese, gebaseerd op de structuur, is dat DnaJB8 niet actief is totdat het zich bindt aan het Huntington-eiwit. Dan kan het Hsp70 aantrekken’, zegt Van der Wel. Een aantal verschillende simulaties en experimenten aan de universiteit van Texas bevestigen dit en laten in detail zien hoe de twee eiwitten samenwerken.
Het eiwit DnaJB8 is vooral te vinden in de testes. Maar in de hersenen, waar de ziekte van Huntington zijn vernietigende werk doet, is een vergelijkbaar eiwit aanwezig, DnaJB6. Het is zeer waarschijnlijk dat dit op dezelfde manier werkt, en verhindert dat de glutamine-rijke eiwitten samenklonteren in de hersencellen van patiënten. Van der Wel: ‘Het kan nog heel wat jaren duren voordat we precies begrijpen hoe dit proces werkt. Maar als dat zo is, kunnen we mogelijk een manier vinden om de activiteit van DnaJB6 te stimuleren waardoor we de eiwitklonten die de ziekte van Huntington veroorzaken zouden kunnen opruimen.’
Referentie: Bryan D. Ryder, Irina Matlahov, Sofia Bali, Jaime Vaquer-Alicea, Patrick C. A. van der Wel, & Lukasz A. Joachimiak: Regulatory inter-domain interactions influence Hsp70 recruitment to the DnaJB8 chaperone. Nature Communications, 11 februari 2021
| Laatst gewijzigd: | 15 februari 2021 15:13 |
Meer nieuws
-
24 maart 2025
RUG 28e in World’s Most International Universities 2025 ranglijst
De Rijksuniversiteit Groningen is door Times Higher Education gerangschikt op de 28e plek in de World’s Most International Universities 2025 ranglijst. Daarmee laat de RUG instellingen als MIT en Harvard achter zich. De 28e plek betekent een stijging...
-
05 maart 2025
Vrouwen in de wetenschap
De RUG viert Internationale Vrouwendag met een bijzondere fotoserie: Vrouwen in de wetenschap.
-
16 december 2024
Jouke de Vries: ‘De universiteit zal wendbaar moeten zijn’
Aan het einde van 2024 blikt collegevoorzitter Jouke de Vries terug op het afgelopen jaar. In de podcast gaat hij in op zijn persoonlijke hoogte- en dieptepunten en kijkt hij vooruit naar de toekomst van de universiteit in financieel moeilijke tijden...
