Simpel leven maken
Het is een van de meest fundamentele vragen in de wetenschap: hoe kunnen levenloze moleculen samen een levende cel vormen? Bert Poolman, hoogleraar Biochemie aan de RUG, werkt al zo’n twintig jaar aan dit probleem. Hij probeert te begrijpen wat leven is door het na te bouwen, met behulp van vereenvoudigde kunstmatige versies van biologische systemen, de onderdelen voor een synthetische cel. Poolman publiceerde onlangs twee artikelen, in Nature Nanotechnology en Nature Communications , waarin hij een systeem beschrijft dat energie omzet waarna de reactieproducten hiervan tussen synthetische cellen worden uitgewisseld, en een systeem dat voedingsstoffen in cellen kan concentreren.
FSE Science Newsroom | René Fransen

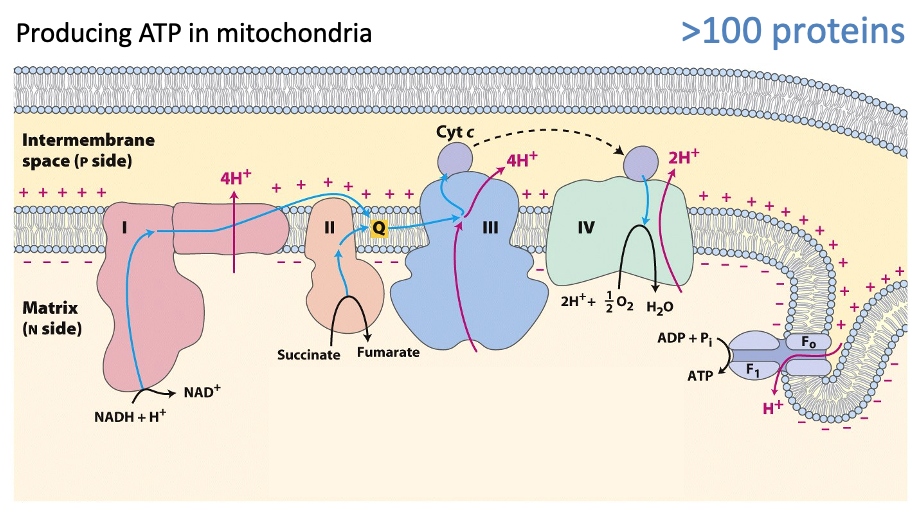
Zes Nederlandse onderzoekinstituten werken samen om de elementen te bouwen die nodig zijn voor een synthetische cel. Dat gebeurt in het consortium BaSyc (Building a Synthetic Cell). De groep van Poolman werkt aan energie-omzetting, zoals dat in cellen gebeurt in de energiefabriekjes van de cel, de zogeheten mitochondriën. Die zetten het molecuul ADP om in ATP, en dat laatste is de standaard ‘brandstof’ die alle cellen gebruiken om te kunnen functioneren. Door ATP weer om te zetten in ADP komt er energie vrij, die processen in de cel kan aandrijven.
Kunstmatige energiefabriekjes
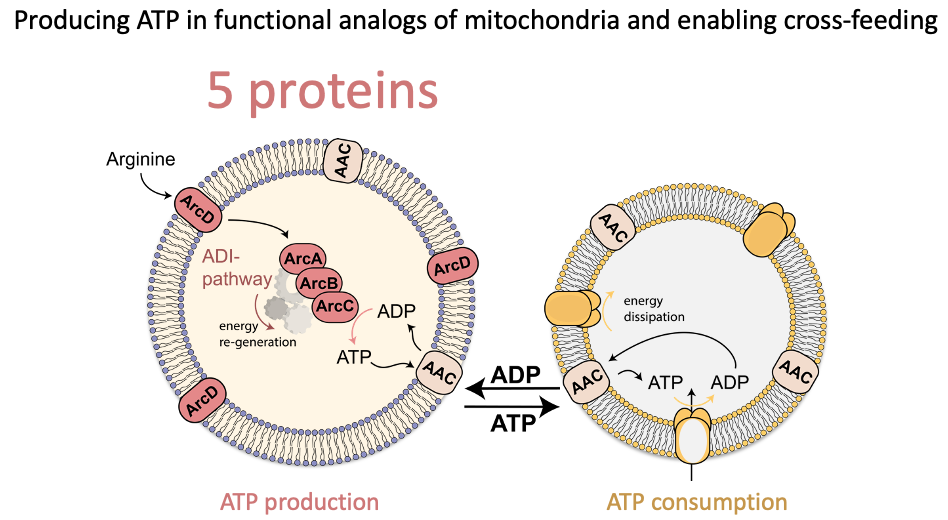
‘Terwijl de mitochondriën uit honderden onderdelen bestaan heeft ons systeem voor energieomzetting er maar vijf,’ vertelt Poolman. ‘We hebben het zoveel mogelijk vereenvoudigd.’ Dat klinkt misschien raar, want de evolutie is toch heel goed in het maken van goed functionerende systemen. ‘Maar evolutie is eenrichtingsverkeer, het bouwt voort op bestaande onderdelen en dat maakt het resultaat vaak erg complex’, legt hij uit. Terwijl een kunstmatige replica gericht ontworpen is voor een specifieke taak.
De vijf onderdelen zijn in blaasjes geplaatst, kleine cel-achtige zakjes die uit de omringende vloeistof ADP kunnen opnemen en het aminozuur arginine. Deze arginine wordt ‘verbrand’ (via een chemische reactie die deaminatie heet) en levert zo energie waarmee ATP kan worden geproduceerd. De zakjes scheiden dat molecuul vervolgens weer uit. Poolman: ‘Zo’n vereenvoudiging heeft natuurlijk wel gevolgen: wij kunnen alleen arginine als energiebron gebruiken, terwijl echte cellen allerlei moleculen verbranden, zoals aminozuren, vetten en suikers.’
Naast dit eerste blaasje maakte de groep van Poolman een tweede, dat de uitgescheiden ATP opneemt en daarmee een energie-verbruikend proces aandrijft. Die reactie zet ATP weer om in ADP, dat vervolgens wordt uitgescheiden en dan weer opgenomen kan worden door het eerste (ATP producerende) blaasje, zodat de kringloop gesloten is. Zo’n cyclus van ATP productie en gebruik is de basis van de stofwisseling in alle levende cellen. Dit drijft de ‘machinerie’ aan die zorgt voor groei, celdeling, eiwitproductie, het kopiëren van DNA en meer.

Uiteindelijk kan dit een blauwdruk voor leven opleveren, iets dat tot nu toe nog ontbreekt in de biologie.
Een kunstmatige pomp
Poolman bouwde ook nog een tweede module, met een andere functie. Dit is een blaasje waarin een chemisch proces ervoor zorgt dat er een negatieve lading ontstaat. Zo vormt zich een elektrische potentiaal (een spanningsverschil) met de buitenwereld, net als in een elektronisch circuit. Via de elektrische potentiaal koppelt het blaasje de verplaatsing van geladen deeltjes aan het opnemen van voedingsstoffen, via transporteiwitten. Deze eiwitten zitten in de membraan die de buitenkant van het blaasje vormt en werken een beetje zoals een waterrad: positief geladen protonen ‘stromen’ van buiten het blaasje naar het negatief geladen binnenste. Die stroom drijft het transport aan, in dit geval het importeren van lactose (melksuiker). Ook dit is een heel gewoon proces, waarvoor in levende cellen een groot aantal onderdelen nodig is. Poolman bouwde dit na met behulp van slechts twee onderdelen.
Toen hij het wetenschappelijke artikel waarin dit tweede blaasje is beschreven naar een tijdschrift opstuurde, kreeg hij van een van de beoordelaars de vraag of het niet mogelijk was iets te doen met die opgenomen lactose. Cellen gebruiken dit immers om nuttige bouwstenen te maken. Poolman accepteerde deze uitdaging en voegde drie enzymen toe aan zijn blaasje, die ervoor zorgen dat de lactose wordt geoxideerd, waarna het molecuul NADH wordt geproduceerd. ‘Dit molecuul speelt een cruciale rol bij het juist functioneren van alle cellen,’ legt Poolman uit. ‘Door NADH productie toe te voegen laten we ook zien dat het mogelijk is ons systeem uit te breiden.’
Maar hoe zit het met die synthetische cel?
Dat Poolman synthetische versies heeft gemaakt van twee belangrijke processen voor leven is fascinerend, maar er zijn nog heel wat stappen nodig om een zelfstandig groeiende en delende synthetische cel te maken. ‘De volgende stap is dat we ons systeem dat energie voor de stofwisseling levert willen koppelen aan een synthetisch systeem voor celdeling, dat collega’s elders hebben gebouwd’, zegt Poolman.
Het BaSyc programma loopt wel binnen enkele jaren af, maar er is al financiering voor een nieuw programma. Een groot consortium van Nederlandse onderzoeksgroepen, waarin Poolman een van de leiders is, ontving recent 40 miljoen euro om leven te maken uit niet-levende modules. Het EVOLF project zal ook weer tien jaar lopen, en wil nog veel meer levenloze modules produceren om levende cellen mee te maken. ‘Uiteindelijk kan dit een blauwdruk voor leven opleveren, iets dat tot nu toe nog ontbreekt in de biologie’, concludeert Poolman. ‘Daar zouden allerlei toepassingen uit kunnen komen, maar het helpt ons vooral om beter te begrijpen wat leven nu eigenlijk is.’
Referenties:
Miyer F. Patiño-Ruiz, Zaid Ramdhan Anshari, Bauke Gaastra, Dirk J. Slotboom & Bert Poolman: Chemiosmotic nutrient transport in synthetic cells powered by electrogenic antiport coupled to decarboxylation . Nature Communications, 12 september 2024
Laura Heinen, Marco van den Noort, Martin S. King, Edmund R.S. Kunji and Bert Poolman: Synthetic syntrophy: Synthetic syntrophy for adenine nucleotide cross-feeding between metabolically active nanoreactors . Nature Nanotechnology 21 oktober 2024.
| Laatst gewijzigd: | 24 oktober 2024 11:50 |
Meer nieuws
-
25 april 2025
Topwetenschapper Arnold Driessen gelauwerd
Op 25 april 2025 ontving Arnold Driessen (Horst, 1958) een Koninklijke Onderscheiding. Driessen is hoogleraar Moleculaire Microbiologie en voorzitter van de onderzoeks- en basiseenheid Moleculaire Microbiologie bij de Faculteit Science & Engineering...
-
24 april 2025
Uitgelichte publicaties april 2025
Het malaria-geneesmiddel mefloquine kan ook helpen tegen genetische ziekten zoals taaislijmziekte, Duchenne spierdystrofie of sommige vormen van kanker.
-
22 april 2025
Microplastics: wat doen ze met ons?
Prof. Barbro Melgert heeft ontdekt hoe microplastics de longen aantasten en kan uitleggen hoe we onze blootstelling kunnen verkleinen.
