Pieken om te delen: Instabiel eiwit is hoofdschakelaar voor celdeling
De deling van gistcellen lijkt te beginnen wanneer er in de cel een toename is in de concentratie van Cln3, een zeer instabiel eiwit. Die Cln3-concentratie bereikt pas een voldoende hoogte om celdeling in gang te zetten als de productie van nieuwe eiwitten sneller verloopt dan de toename van de celgrootte. RUG-onderzoekers hebben deze ontdekking, samen met collega’s uit Zwitserland en België, op 4 november 2019 gepubliceerd in het tijdschrift Nature Cell Biology.
Cellen kunnen niet denken, maar moeten toch op een of andere manier ‘besluiten’ of ze gaan delen of liever in rust blijven, afhankelijk van de omstandigheden rondom hen. Zo’n dertig jaar geleden is ontdekt dat het cycline-afhankelijke kinase (cyclin-dependent kinase, CDK) complex de belangrijkste regulator van de celdelingscyclus is. Maar het exacte mechanisme dat de cel aan een nieuwe ronde celdeling laat beginnen, bleef onbekend.
Puzzel
Drie jaar geleden liet systeembioloog prof.dr. Matthias Heinemann van de Faculty of Science and Engineering (RUG) zien dat oscillaties in de celstofwisseling lijken op te treden als ‘dirigent’ voor de celcyclus van gist. Zijn onderzoeksgroep heeft nu een nieuw stukje van de puzzel gevonden: een eiwit in gist met de naam Cln3. Het was al bekend dat dit Cln3 een complex vormt met het CDK, wat vervolgens een proces in gang zet dat de cel aan een nieuwe delingscyclus laat beginnen. “Maar omdat de concentratie van Cln3 tijdens de hele celcyclus constant blijft, was het onduidelijk hoe dit eiwit het besluit om te gaan delen kon beïnvloeden”, legt Heinemann uit. Daarnaast is Cln3 een zeer instabiel eiwit, wat het moeilijk maakt om de concentratie ervan te meten. Want zodra het is aangemaakt, wordt het direct weer afgebroken.
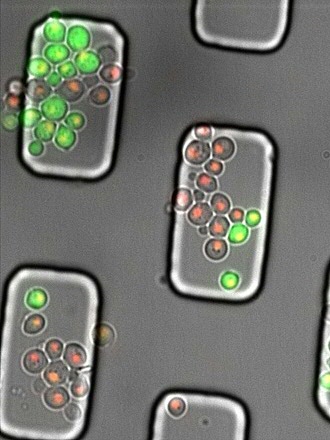
Groen fluorescerend
Om de rol van Cln3 in de celdeling te onderzoeken gebruikte Heinemann samen met zijn team, waaronder Andreas Milias-Argeitis, een manier om de productiesnelheid van Cln3 in de tijd te meten. De klassieke manier om dat te doen is door aan het gen voor Cln3 een gen te koppelen voor de productie van GFP, een groen fluorescerend eiwit. Daardoor ontstaat een Cln3-GFP fusie-eiwit dat groen oplicht. “Maar in dit geval wordt het GFP gelijk met het Cln3 afgebroken, zodat er geen fluorescentie zichtbaar is”, legt Milias-Argeitis uit. Dit probleem is opgelost door een klein eiwitje tussen Cln3 en GFP in te plaatsen. “Dat extra eiwitje breekt spontaan doormidden, zodat het GFP vrijkomt van het Cln3 zodra het eiwit is gemaakt. Daarna wordt het Cln3 afgebroken, maar het GFP blijft zichtbaar in de cel aanwezig.” Op die manier is de snelheid gemeten waarmee Cln3 wordt aangemaakt.
‘Lab op een chip’
Athanasios Litsios, de eerste auteur van het artikel over dit onderzoek, bedacht het idee van dit spontaan brekende eiwit. Hij heeft vervolgens heel zorgvuldig een groot aantal metingen uitgevoerd van de concentratie GFP in individuele cellen, gelijktijdig met metingen van het celvolume. Dat gebeurde in een ‘lab op een chip’ van microscopisch kleine met vloeistof gevulde kanaaltjes. Die metingen leidden tot de conclusie dat de Cln3-concentratie een piek vertoont net voordat de cel besluit om te gaan delen. Heinemann legt uit dat er eerder metingen van Cln3 zijn gedaan, maar die waren gebaseerd op andere technieken, waarbij alleen naar gemiddelden in grote aantallen cellen in kweekflessen is gekeken, dus niet naar individuele cellen. “In dat geval verdwijnt de piek in Cln3-concentratie, omdat die niet in alle cellen gelijktijdig optreedt.”

Ontkoppeling
Wat opviel, is dat de piek in concentratie optrad tijdens een fase waarin de snelheid van eiwitproductie groter was dan de toename in celvolume. Milias-Argeitis verklaart dat zo: “Het betekent dat er een ontkoppeling is tussen eiwitproductie en de metabole processen die zorgen voor toename in volume van de cel.” Deze ontkoppeling kan een deel verklaren van de oscillaties in de stofwisseling die Heinemann eerder ontdekt heeft, en die ook een rol spelen bij de celdeling.
Intrigerend
De bevindingen uit dit onderzoek suggereren dat een cel 'beslist' om te gaan delen als er een piek is in de Cln3-concentratie en dat die piek weer het gevolg is van een toename in de snelheid van eiwitproductie. Misschien werkt dit systeem als een manier waarop de cel kan ‘vaststellen’ of de omstandigheden goed zijn voor eiwitproductie – want dat is nodig voor een geslaagde celdeling. Heinemann stelt dat de observatie van een toename in eiwitproductie vlak voor het besluit om te gaan delen intrigerend is. “We moeten hier verder naar kijken om te ontdekken welke biofysische processen verantwoordelijk zijn voor die toename en welke moleculaire mechanismen daar voor zorgen.”
Referentie
Athanasios Litsios, Daphne H. E. W. Huberts, Hanna Terpstra, Paolo Guerra, Alexander Schmidt, Katarzyna Buczak, Alexandros Papagiannakis, Mattia Rovetta, Johan Hekelaar, Georg Hubmann, Marten Exterkate, Andreas Milias-Argeitis, Matthias Heinemann: Differential scaling between G1 protein production and cell size dynamics promotes commitment to the cell division cycle in budding yeast. Nature Nature Cell Biology 4 november 2019 - DOI 10.1038/s41556-019-0413-3
| Laatst gewijzigd: | 20 januari 2025 08:38 |
Meer nieuws
-
25 april 2025
Topwetenschapper Arnold Driessen gelauwerd
Op 25 april 2025 ontving Arnold Driessen (Horst, 1958) een Koninklijke Onderscheiding. Driessen is hoogleraar Moleculaire Microbiologie en voorzitter van de onderzoeks- en basiseenheid Moleculaire Microbiologie bij de Faculteit Science & Engineering...
-
24 april 2025
Uitgelichte publicaties april 2025
Het malaria-geneesmiddel mefloquine kan ook helpen tegen genetische ziekten zoals taaislijmziekte, Duchenne spierdystrofie of sommige vormen van kanker.
-
22 april 2025
Microplastics: wat doen ze met ons?
Prof. Barbro Melgert heeft ontdekt hoe microplastics de longen aantasten en kan uitleggen hoe we onze blootstelling kunnen verkleinen.
