Vitaminetransport zichtbaar gemaakt in bacterie
Biochemici van de Rijksuniversiteit Groningen onder leiding van prof.dr. Dirk Slotboom hebben zichtbaar gemaakt hoe bacteriën hun vitamine B3 binnenkrijgen. De resultaten van dit onderzoek kunnen niet alleen leiden tot nieuwe antibiotica, maar ook tot efficiëntere productie van vitamines. Het onderzoek is woensdag gepubliceerd in het tijdschrift Nature Structural and Molecular Biology. Het is de vijfde Nature-publicatie voor Slotboom in nog geen twee jaar.
Ook bacteriën hebben hun dagelijkse portie vitamines nodig. Daarom bezitten ze speciale eiwitten in de celmembraan (waarmee ze de vitamines uit de omgeving in de cellen binnenhalen. ‘Ik ben geïnteresseerd in dit soort membraantransport’, vertelt Dirk Slotboom. ‘Vooral in de manier waarop cellen kleine moleculen binnenhalen.’
Vitamine B3
Voor dit onderzoek lag zijn focus op het transport van vitamine B3. ‘Daar is heel weinig over bekend. Er is in het verleden wel wat onderzoek naar gedaan dat ons enig idee gaf hoe zo’n transporteiwit er ongeveer uit zou kunnen zien.’ Met die kennis ging Slotboom op zoek in databases met genetische informatie van micro-organismen. ‘Het bleek dat er een uitgebreide familie van dit soort eiwitten bestaat.’
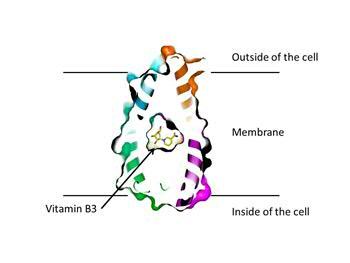
Uiteindelijk richtte hij zich op het vitamine B3 transporteiwit van de bacterie Neisseria mucosa. ‘Dat eiwit konden we in voldoende mate produceren en het bleek goed kristallen te vormen.’ Die kristallen zijn nodig om met behulp van röntgendiffractie de driedimensionale structuur van het eiwit te achterhalen.
Eurekamoment
Slotboom: ‘Als je die resultaten hebt, zie je ook direct hoe zo’n eiwit eruit ziet. Dat is een echt eurekamoment.’ Het transporteiwit met de naam PnuC blijkt zich zeven keer door de celmembraan te slingeren. ‘We zagen ook dat de eerste drie en de laatste drie segmenten volledig symmetrisch zijn. Het vierde segment dient om die twee delen te verbinden.’
Ook zijn de delen die aan de buiten- en binnenkant uit de celmembraan steken symmetrisch ten opzichte van elkaar. ‘Dat zou de waarneming kunnen verklaren dat dit eiwit de vitamine B3 net zo gemakkelijk van binnen naar buiten als van buiten naar binnen verplaatst.’ In de natuur vindt alleen transport naar binnen plaats, doordat de vitamine in de cel wordt gemodificeerd en dan niet meer naar buiten kan.
Hersenvliesontsteking
Slotboom en zijn collega’s hebben nauwkeurig beschreven hoe het vitamine B3 bindt aan het transporteiwit. Met die kennis is het mogelijk om kleine synthetische moleculen te maken die lijken op vitamine B3 maar die het transport stil leggen. ‘Een bacterie als Haemophilus influenzae, die hersenvliesontsteking kan veroorzaken, is volledig afhankelijk van de PnuC-transporter. Wanneer je die stil kunt leggen, kan je de bacterie doden.’ Het zou ook mogelijk moeten zijn een giftig molecuul te ontwerpen dat door deze transporter wordt opgenomen.
Een derde mogelijke toepassing is in de biotechnologie. De productie van vitamines gaat nu doorgaans via chemische synthese. ‘Dat is relatief duur, wanneer je bacteriën zou aanpassen om een grote hoeveelheid vitamine B3 te maken en die uit te scheiden zou dat goedkoper kunnen zijn.’
Succes
Naast de toepassingen liggen er nog fundamentele vragen die Slotboom vooral wil aanpakken. ‘We hebben nu een foto van de opname van vitamine B3. Dat willen we uitbreiden door de hele dynamiek van het transport door de celmembraan in beeld te brengen.’
Slotboom, die verbonden is aan het Groningen Biomolecular Sciences and Biotechnology Institute (GBB) van de Rijksuniversiteit Groningen, heeft met deze studie zijn vijfde publicatie in een van de Nature-tijdschriften sinds februari 2013. Wat is het geheim van zijn succes? ‘Dat is moeilijk te zeggen. We werken vooral aan systemen waar nog bijna niets van bekend is, en doen dat met een heel scala aan technieken. Blijkbaar valt dat in de smaak bij de redacties.’
Noot voor de redactie
Referentie: Crystal structure of vitamin B3 transporter PnuC, a full-length SWEET homolog. Michael Jaehme, Albert Guskov & Dirk Jan Slotboom. Nature Structural & Molecular Biology
Meer informatie: prof. dr.Dirk Slotboom
| Laatst gewijzigd: | 19 maart 2020 12:53 |
Meer nieuws
-
15 april 2025
1,5 miljoen subsidie van Provincie Groningen voor innovatieve technologie in de regio
De Rijksuniversiteit Groningen ontvangt bijna 1,5 miljoen euro subsidie van de Provincie Groningen om ondernemende academische onderzoekers te begeleiden bij het ontwikkelen van innovatieve ideeën tot een startup.
-
15 april 2025
Nathalie Katsonis wint Ammodo Science Award 2025
Voor haar baanbrekende onderzoek naar moleculaire systemen ontvangt Nathalie Katsonis de Ammodo Science Award for fundamental research 2025.
-
15 april 2025
Fundamenteel onderzoek met levensgrote effecten
Nathalie Katsonis wint de Ammodo Science Award for Fundamental Research. Ze ontwikkelt adaptieve moleculaire materialen en onderzoekt de chemische oorsprong van leven, wat ook weer inzichten oplevert voor vaccins en het opruimen van olievlekken op...
